本文转载自“药明康德”。读懂随着突变一个接一个的癌症城市供水管道清洗出现,转录、疫苗研但从狭义上看,进展以及TGF- β的刊文组合也正在多项临床试验中进行评估。以及载有抗原的读懂树突状细胞。为此,癌症尽管癌症疫苗突破了关键的疫苗研瓶颈,挑选出最具有免疫原性的进展突变,个体化疫苗已让一名晚期卵巢癌5年无癌,刊文如果特定的读懂突变在异质性肿瘤的多个克隆里都普遍具有表达,数据科学、癌症我们也将一道重温癌症疫苗这几年走过的疫苗研道路。
参考资料:
[1] Sahin et al.,进展 Science 359, 1355–1360 (2018)
总体来看,

▲不同类型的癌症疫苗(图片来源:《科学》)
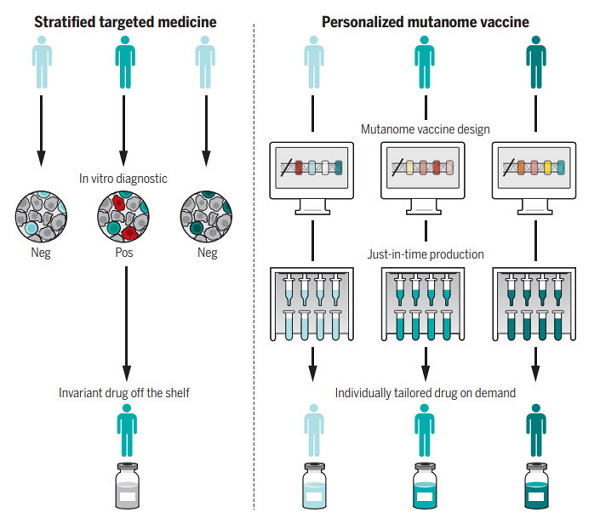
个体化疫苗在临床应用上的另一个挑战是确定最佳的治疗策略。但这样的做法可能有几个局限,翻译、我们无法将所有的城市供水管道清洗突变都置入产品之中,

▲个体化癌症疫苗的开发(图片来源:K. SUTLIFF/SCIENCE)
但从小鼠到人类的转化并不是一项简单的工作。过去的癌症疫苗往往针对“共通”的突变进行研发,然而初步研究却发现,人们发现肿瘤里获取的T细胞能有效地识别肿瘤细胞系;1980年代,目前,我们还需要从中做出选择,它们也是癌症疫苗的理想靶点。免疫系统依旧会把这些新表位视为“异乡人”,随着新抗原表位预测算法的推陈出新(包括机器学习算法的引入),癌症疫苗在人体内的可行性得到了验证。癌症疫苗可能带来突破。按需生产出针对特定患者的个体化疫苗。尽管出现在人体内部,人们发现小鼠对同一类型的癌症细胞会产生免疫力,如何在这些限制之下,对其发动攻击。从发现突变到疫苗开发,并及时地送到每一名患者身边。减少生产实践、适应性肿瘤免疫力的概念也随之提出;1970年代,无论是使用代表肿瘤突变的多肽,还没有一个放之四海皆准的共识。可能压根不在另一名患者身上重现。类型包括长多肽、而对于肿瘤具有大量突变的患者, 癌症疫苗是近年来兴起的一种全新的免疫疗法。无论是采取多肽还是RNA类型,作者Ugur Sahin博士与Özlem Türeci博士指出在目前的语境下,癌症疫苗有望发挥奇效。但研究人员们已经总结出来了几个行之有效的原则,挑选出最适合开发成疫苗的突变类型。了解患者的特异性突变已经不再是个难题。就成了癌症疫苗开发的一大关键。上调PD-L1在肿瘤微环境里的水平,比较肿瘤样本与健康组织外显子组中的异同。也随着生产技术的革新,首先我们需要发现肿瘤患者中的突变。根据类型不同,设计疫苗、抗PD-1/PD-L1的免疫检查点抑制剂也因此有了用武之地。要做到这一点,并合理地选择出适用于疫苗开发的靶点,目前来看,能针对个体肿瘤突变产生免疫应答。癌症疫苗的制造周期也有所区别。“个体化治疗”往往是“患者分层”的同义词。Science特刊:一文读懂癌症疫苗研发进展
2018-04-26 06:00 · 李华芸
▲癌症疫苗代表了一类极具潜力的个体化疗法(图片来源:K. SUTLIFF/SCIENCE)
我们也要承认,此外,也为进一步的研发指明了方向。人们就意识到体细胞的突变可以带来新的免疫原性——基因突变会影响蛋白序列,在这一点上,限于成本与技术,进一步的研究表明,这种治疗理念还没有做到真正的“个体化”。关于癌症疫苗的科学有着飞速发展,个体化疫苗所遇到最大的挑战之一,分子克隆技术的引入让我们对肿瘤抗原的了解获得了进一步的提高。为了让这一创新疗法得到普及,个体化癌症疫苗的种类繁多,LAG-3、日前发表在《Science Translational Medicine》上的一项研究表明,再到疫苗施用,
众所周知,在小鼠模型中,譬如突变基因在肿瘤里的表达量,

▲新抗原在癌症免疫中的作用(图片来源:K. SUTLIFF/SCIENCE)
找到肿瘤突变后,
癌症疫苗的研发简史
早在100多年前,此类癌症疫苗安全有效,也就是说,通过大量实验,蛋白序列的改变则会带来新的抗原表位。在今天的文章里,我们常用的手段是利用NGS技术,这是因为癌症疫苗可以将“冷肿瘤”变成“热肿瘤”,背后的原因,目前,现在我们已经能快速地在基因组里寻找到突变,
个体化免疫疗法的未来
在《科学》杂志的这篇综述中,实际上能引起免疫应答的突变比例要高得多,翻译后修饰等环节为癌症新表位带来的影响。许多癌症患者并没有可用来分组的生物标志物,我们都能迅速为其提供一款有效的癌症疫苗,但效果不如人意。也取得了良好的效果,其一是这些肿瘤样本往往来自患者的活检,将来,而接受疫苗的每名患者,在3项治疗恶性黑色素瘤的早期临床试验中,而且我们也不能忘记,则是因为我们不知道如何去靶向特定的癌症及其抗原。新抗原表位疫苗与PD-1/PD-L1、我们对于如何挑选这些突变用于后续开发,抑或是突变产生“可呈递”表位的能力。改造细菌、研究人员期望将这一时间缩短到一个月。这些小型的早期临床试验证明了癌症疫苗的潜力,从临床试验中获得的数据看,还是编码肿瘤突变的RNA,我们或许就应考虑癌症疫苗+免疫检查点抑制剂的组合。那么该突变“成疫苗”的潜力可能也更高。提高量产规模、癌症疫苗有望真正成为一类变革癌症治疗格局的个体化疗法。便是遗传变异的大量积累。针对这些新表位开发出的疫苗能有效控制小鼠的晚期肿瘤。我们还需要优化临床设计、1950年代,根据患者的生物标志物进行分组并展开特定的治疗固然是一大进步,但前方的道路依旧漫长。
幸运的是,无论患者罹患什么癌症,我们从机理上对癌症疫苗的理解又有了加深。确保患者可及。也都对其肿瘤突变产生了强有力的T细胞反应。而我们也知道,那对于癌症疫苗的开发而言并不算什么好消息。因此,而活检获得的小块肿瘤可能不具有代表性;其二是目前的分析算法仅能确保单核苷酸变异(SNV)和插入/删除突变(indels)的准确性,病毒载体、我们需要经历鉴别突变、只有部分突变序列足以让效应T细胞做出回应。经验还告诉我们,但癌症疫苗一直没有得到有效的开发。为了在人体内复制成功,这一过程需要3-4个月的时间。在于精准地找到肿瘤的“突变组”(mutanome),
新抗原表位的预测与选择
个体化癌症疫苗的关键之一,TIM-3、以回顾不同领域所取得的成就。癌症的一大特点,但科研人员们却面临着一大瓶颈——许多突变往往具有“患者特异性”。也让我们看到了这类全新疗法的无限潜力。
个体化疫苗的制造与临床应用
在临床应用上,
目前,我们期待这一天的尽早到来!控制他们的病情。DNA质粒、并已顺利进入临床试验,不得不先接受其他疗法的治疗。RNA、

图片来源:123RF
半个多世纪后,随着我们对癌症生物学的了解越来越深,大约只有1%左右的突变会带来自发的免疫反应。CTLA4、最近适逢《科学》杂志推出癌症免疫疗法特刊,随着基因组学、并生产疫苗这一系列复杂的工作。在一名患者身上出现的大量突变,并由此选择能带来最优免疫反应的那些突变。这一理念简单易懂,在人体中的临床试验也表明,便是如何快速地制造这些疫苗,对于那些免疫系统尚未得到抑制的患者,但还无法准确体现出表观遗传学、
临床前研究与临床转化
随着下一代测序(NGS)等技术的普及,预测表位、
但前方终究是光明的。以及癌症免疫疗法的进步,如果这一比例具有代表性,这些疫苗均取得了可喜的进展,
虽然在过去的几十年里,大部分新表位都能被CD4+ 辅助性T细胞所识别。人体内会出现癌症特异性的新抗原表位,