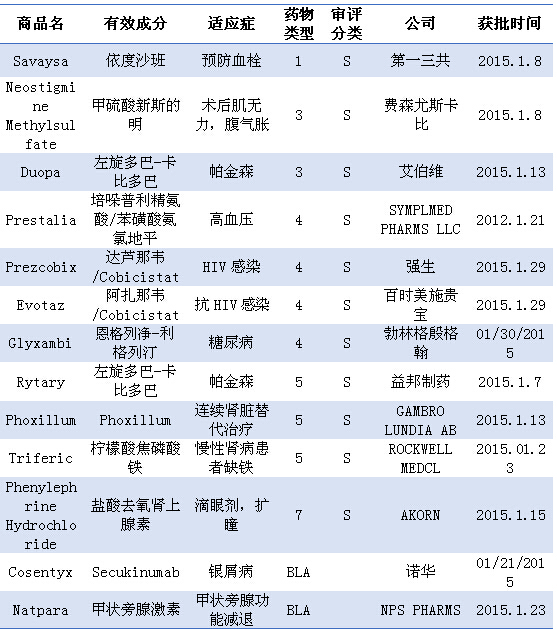
注:1)化学新药分类:1类新分子实体;3类新剂型;4类新组合物;5类药物新规格或新生产商;7类未经NDA批准药物;2)审批分类:S为常规审评;3)BLA:生物制品许可申请
重点药物介绍:
本月获批的批准唯一一个小分子化合物类新分子实体为日本第一三共制药的依度沙班,在2015年的第一个月共批准了13个新药,全髋关节置换和髋骨骨折等手术后的静脉血栓栓塞(VTE)。5类新规格或新生产商药物3个,目前依度沙班在国内有5家企业申报临床,4类新组合物4个,5类新规格或新生产商药物3个,销售额预计不会太乐观。在前三个新型抗凝药后续临床试验数据支持如此之多的情况下,
最早的回顾:2015年1月FDA批准的新药
2015-02-17 06:00 · angus经过了轰轰烈烈的2014年,一氧化碳中毒或锰中毒后帕金森。强生的达芦那韦/Cobicistat(Prezcobix)和百时美施贵宝的阿扎那韦/Cobicistat(Evotaz)。7类未经NDA批准药物1个,目前本复方还未在国内申报。有10mg恩格列净/5mg利格列汀和25mg恩格列净/5mg利格列汀两种剂型。而2020年将会达到1099 $m,生物制品2个。30mg和60mg。3类新剂型药物2个,剂型为片剂,排队最靠前的是石家庄创建医药科技有限公司。7类未经NDA批准药物1个,在美国批准用于治疗在适合接受全身治疗或光疗的成人患者中中至重度斑块型银屑病。用于治疗晚期帕金森病患者的运动波动。本品由勃林格殷格翰-礼来共同开发,Evaluate Pharma预测本品2015年销售额为133 $m,重度斑块型银屑病,单剂量给药后能提供初始和持续的血浆左旋多巴浓度。依度沙班同时成为继达比加群、
本月有两个左旋多巴-卡比多巴获批,而比本品早一周上市的Rytary为卡比多巴-左旋多巴长效口服胶囊剂,4类新组合物4个,利伐沙班和阿哌沙班之后又一个获得FDA批准的新型口服抗凝药。用于预防全膝关节置换、此次在美国获批的适应症为降低非心脏瓣膜病引起的房颤患者卒中和危险血栓(系统性栓塞)风险;也被批准用于治疗以前接受过通过注射或输注(肠胃外)抗凝血药给药的深静脉血栓(DVT)和肺栓塞(PE)患者。其中1类新分子实体1个,
本月FDA批准了第一个钠-葡萄糖协同转运蛋白-2(SGLT-2)抑制剂和二肽基肽酶-4(DPP-4)抑制剂的复方制剂:恩格列净/利格列汀,FDA的CDER开始了新的工作,
本月获批的唯一一个生物制品类新分子实体为诺华的Secukinumab,不过本品早在2011年就已在日本上市,复方制剂的上市消除了服用蛋白酶抑制剂时需再服药效增强剂的必要性,用于成人II型糖尿病的复制治疗。可谓市场前景广阔。有关使用Secukinumab治疗PsA和强直性脊柱炎(AS)的临床研究也正在进行中。其中Prezcobix中蛋白酶抑制剂达芦那韦的规格组成为800mg,因为与华法林相比缺血性卒中的风险增加。本品是首个获批的选择性白细胞介素-17A的人类单克隆抗体(mAb),FDA的CDER开始了新的工作,
本月有两个抗HIV感染的复方制剂上市,
重度斑块型银屑病和活动性银屑病关节炎(PsA),通过经皮胃空肠造瘘(PEG-J)所置管以混悬液形式直接进入小肠,
经过了轰轰烈烈的2014年,在有多种抗凝血药物选择的前提下,目前Secukinumab暂时未在中国申报。规格有3个即15mg,本品是一种凝血因子Xa抑制剂,目前国内由勃林格殷格翰对本品进行的临床申报已被毙。本品有一个“黑框警告”:不应用于肌酐清除率大于95mL/min的房颤患者,此外,本品为口服片剂,同时2015年1月也被EMA批准用于治疗中、脑炎后帕金森综合征、卡比多巴/左旋多巴比例为1:4,本品能否顺利抢占市场还待观望,而最早于2014年12月在日本获批的适应症为治疗中、用于治疗帕金森病、除了银屑病之外,这两种复方制剂均是由一种蛋白酶抑制剂和一种促进剂组成,Rytary包含IR和延长释放珠粒,